Товароведение
- Общее товароведение пищевых и вкусовых товаров
- Товароведение зерна, мучных, крупяных изделий
- Определение качества зерна, муки, крупы
- Товароведение сельскохозяйственного сырья
- Товароведение лекарственно-технического сырья
- Товароведение масличного сырья
- Справочник товароведа: Технологии и оборудование
- Справочник товароведа: Продовольственная таксономия
- Упаковка товара
- Стеклянная тара
Реактивы и техника приготовления растворов
Приготовление растворов, применяемых при определении крахмала и при других анализах.
Приготовление 1,124%-ного раствора соляной кислоты для определения крахмала. Берем 26,6 мл НС1 (плотность 1,19) или 40 мл (плотность 1,125) и разбавляем дистиллированной водой до 1 л.
Правильность концентрации проверяем титрованием 0,1 н. раствором NaOH по метилоранжу; 1 мл правильно приготовленной кислоты соответствует
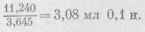
раствора NaOH. Отклонения допускаются но выше ±0,002%.
Приготовление кислого раствора железоаммиачиых квасцов. 100 г квасцов растворяем в 500 мл воды, добавляем 100 мл концентрированной серной кислоты (плотность 1,84) и после охлаждения доводим объем до 1 л.
Приготовление нормальных растворов марганцовокислого калия. Берем грамм-эквивалент марганцовокислого калия (31,65 г) для нормального и соответственно в 10, 100 раз меньше для деци- и сантинормальных растворов. Навеску для приготовления раствора требуемой нормальности растворяем в дистиллированн ой воде, долго и энергично перемешивая ее без нагревания. Полученный раствор доводим до 1 л той же водой, выдерживаем в покое не менее 10-12 дней, затем устанавливаем его титр по щавелевой кислоте.
Берем 20 мл точно приготовленного раствора щавелевой кислоты требуемой нормальности, смешиваем приблизительно с 60-80 мл воды, подкисляем 2 мл серной кислоты (H2S04 плотность 1,84 разбавляем водой в соотношении 1 : 2) и оттитровываем раствором марганцовокислого калия. Последний надо хранить в темном месте в склянке из темного стекла, но для титрования раствор можно наливать в открытую бюретку.
Первые порции приливаемого раствора трудно обесцвечиваются, поэтому для ускорения реакции нагреваем раствор до температуры 60-70°С. Чем ближе к концу, тем реакция идет быстрее. Титруем до появления ясно-розовой окраски.
Приготовление растворов йода. 1. Для приготовления 0,5%-ного раствора берем 1 г йодистого калия, растворяем в 5 мл воды, затем прибавляем 0,5 г кристаллического йода и после растворения последнего объем раствора доводим до 100 мл.
2. Для приготовления децинормального раствора йода:
растворяем 12,7 г металлического йода в водном растворе йодистого калия (25 г KJ, 50-60 мл воды) и разбавляем до 1 л водой. Раствор следует хранить в склянке с пришлифованной пробкой;
растворяем 24,8 г серноватистокислого натрия (гипосульфит) в 1 л прокипяченной воды. Этот раствор храним в течение 10-12 дней в темном месте, в хорошо закрывающейся посуде, после чего определяем поправку;
приготовляем раствор двухромовокислого калия - 49,033 г/л перекристаллизованной соли.
Титр раствора йода устанавливаем по раствору серно-ватистокислого калия, а последний предварительно устанавливаем по раствору двухромовокислого калия.
Приготовление раствора гипосульфита Na2S203 (сер-новатистокислый натрий). Молекулы его кристаллизуются с пятью молекулами воды, поэтому для расчета берем Na2S203-5H20. В основе титрования раствором гипосульфита лежит следующая оеакпия
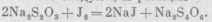
Так, одна грамм-молекула гипосульфита соответствует одному грамм-атому йода, который, в свою очередь, эквивалентен одному грамм-атому водорода. Поэтому для получения нормального раствора необходимо в 1 л раствора иметь точную массу одной грамм-молекулы кристаллического серноватистокислого натрия, т. е. 248,22 г, а для приготовления 0,1 н. раствора - в 10 раз меньше, т. е. 24,822 г на 1 л раствора. Но раствор гипосульфита в первый момент после приготовления изменяет свой титр вследствие разлагающего действия находящейся в дистиллированной воде угольной кислоты.
Титр становится выше, так как образовавшаяся сернистая кислота требовала бы больше йода, чем то количество серноватистой кислоты, из которой она образовалась. Поэтому обычно приготовляют раствор гипосульфита, а титр устанавливают после того, как вся находящаяся в дистиллированной воде угольная кислота войдет в обменное разложение с гипосульфитом. После этого раствор сохраняется в течение нескольких месяцев без заметного изменения. Обычно титр устанавливают через 10-12 дней после приготовления раствора.
Для приготовления раствора гипосульфита потребное количество его растворяем в предварительно прокипяченной для удаления углекислоты дистиллированной воде. Охлаждаем воду в сосуде с пробкой, в которую вставлена трубка с натронной известью для поглощения углекислоты из воздуха.
Установка титра гипосульфита посредством двухромовокислого калия основана на реакции окисления йодистого калия раствором К2Сг207 в присутствии кислоты с выделением йода, который затем надо оттитровывать раствором гипосульфита.
При этом происходит следующая реакция: 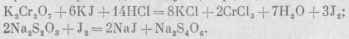
Из реакции видно, что одна молекула двухромовокис-лого калия соответствует шести атомам йода; следовательно, грамм-эквивалент его в данном случае будет равен молекулярной массе, деленной на шесть, что составит
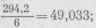 таким образом, если растворить 49,033 г в литре раствора, получим нормальный раствор двухромо-вокислого калия.
таким образом, если растворить 49,033 г в литре раствора, получим нормальный раствор двухромо-вокислого калия.
В зависимости от нормальности устанавливаемого раствора гипосульфита приготавливаем такой же нормальности раствор двухромовокислого калия. Например, если раствор гипосульфита 0,1 н., то берем навеску очищенного К2Сг207 из расчета 4,9033 г на 1 л. Но такого большого количества раствора не требуется, поэтому его можно уменьшить в зависимости от потребности. Для этого берем навеску двухромовокислого калия в 1,226 г и растворяем ее в мерной колбе объемом 250 мл дистиллированной водой. Сначала берем воды примерно 1/3 колбы и при осторожном взбалтывании растворяем навеску двухромовокислого калия. Когда все кристаллы перейдут в раствор, добавляем воду до метки, закрываем колбу пробкой и тщательно смешиваем раствор. Затем берем 25 мл раствора двухромовокислого калия и пипеткой переносим в колбу емкостью 400-500 мл. Предварительно в колбу приливаем 10 мл 10%-ного раствора йодистого калия и 5 мл соляной кислоты (1 : 5). Смеси даем стоять в течение 5 мин, прикрыв горлышко колбы стеклышком. Происходит реакция с выделением йода, вследствие чего раствор приобретает цвет раствора йода. Через 5 мин добавляем 200 мл дистиллированной воды и приливаем из бюретки раствор гипосульфита.
Титрование ведем осторожно (чтобы точнее определить конец реакции), постоянно взбалтывая раствор до получения слабо-желтого окрашивания. Затем добавляем 1-2 мл растворимого крахмала (1%-ный раствор) и продолжаем приливать раствор гипосульфита до исчезновения синей окраски.
Крахмал применяем как индикатор, так как с йодом он дает синее окрашивание. Как только последнее количество содержащегося в растворе йода вступит в реакцию с гипосульфитом, титруемый раствор обесцветится.
Примерный расчет титра гипосульфита по двухромовокислому калию. Навеску очищенного К2Сг20, в количестве 1,226 г растворяем в мерной колбе на 250 мл.
Вычисляем средний результат, т. е.:

Следовательно, этот титр гипосульфита слабее 0,1 н., так как если бы он был 0,1 н., его должно было бы пойти 25 мл, а пошло больше. Находим поправку до 0,1 н. раствора гипосульфита, на которую надо умножить каждый миллилитр раствора
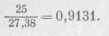
Установка титра гипосульфита посредством йода. Атомная масса йода равна 127 г, эквивалент его равен атомной массе. Если раствор гипосульфита 0,1 и., то для установки его необходимо приготовить также 0,1 н. раствор йода. Следовательно, в 1 л раствора йода должно содержаться 12,7 г, а в 250 мл
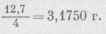
Ввиду большой летучести йода его отвешиваем по разности взвешиваний. Точную навеску, т. е. 3,1750 г, взять также очень неудобно, поэтому берем примерное количество йода, а затем вводим поправку к полученному раствору.
Отвешиваем йод следующим образом. В весовой стаканчик с пришлифованной пробкой помещаем 4-5 г чистого йодистого калия (не содержащего свободного йода) и прибавляем 1 мл дистиллированной воды. Закрыв пробкой стаканчик, взвешиваем и записываем массу а. Затем, открыв стаканчик, прибавляем примерно 3,180 г чистого йода, тотчас закрываем пробкой и снова взвешиваем и получаем массу б. Если из полученной массы вычтем массу стаканчика с йодистым калием и водой, получим навеску взятого йода. Чтобы знать, сколько йода можно взять, на технических весах отвешиваем 1,27 г и помещаем в стаканчик с йодистым калием.
На 1-е титрование 2-е » 3-е » | 27,40 мл 27,35 » 27,40 » |
Для титрования на 25 мл 0,1 н. раствора двухромовокислого калия пошло гипосульфита: растворе йодистого калия, и, следовательно, при переносе навески йода для растворения из стаканчика в мерную колбу можно избежать тех потерь, которые возможны вследствие быстрой летучести кристаллического сухого йода.
После взвешивания содержимое стаканчика (раствор йода в йодистом калии) переносим в мерную колбу через воронку и из промывалки тщательно обмываем стаканчик, пробку и воронку дистиллированной водой. Затем дистиллированной водой раствор дополняем до метки, после чего колбу закрываем пробкой и хорошо взбалтываем. Из полученного таким образом раствора йода берем 25 мл, помещаем в колбу и титруем раствором гипосульфита до слабо-желтой окраски, затем приливаем 1-2 мл раствора крахмала и продолжаем титрование до обесцвечивания синего раствора.
Титр раствора гипосульфита вычисляем из среднего полученного результата второго и третьего определений.
Вычисление поправки раствора йода до 0,1 и. Для получения 0,1 н. раствора йода на 250 мл берем 3,1750 г очищенного йода. Например, взята навеска 3,1250 г, следовательно, данный раствор слабее 0,1 н. и 1 мл его соответствует 3,1250 : 3,1750 - =0,9842 0,1 н. раствора, т. е. поправка этого раствора йода до 0,1 н. равна 0,9842, на которую при вычислении титра гипосульфита надо умножить 25 мл раствора йода, взятого для установки титра гипосульфита.
на 1-е титрование | 24,20 мл |
«2-е » | 24.15 » |
» 3-е » | 24,16 » |
Примерный расчет титра гипосульфита по йоду. Для титрования берем 25 мл раствора йода. Гипосульфита пошло:
Средний результат из трех титрований равен

Поправка до 0,1 н. раствора йода равна 0,9842. Это значит, что на 25-0,9842 мл децинормального раствора йода пошло 24,17 мл гипосульфита, а чтобы определить титр гипосульфита, нужно 
т. е. для получения 0,1 н. раствора гипосульфита нужно каждый миллилитр раствора умножить на 1,018.
- Главная
- Определение качества зерна, муки, крупы
- Реактивы и техника приготовления растворов
- Приготовление растворов, применяемых при определении крахмала и при других анализах.


