Технология производства
- Технология приготовления хлеба
- Технология производства кондитерских изделий
- Технология производства шоколадных изделий
- Технология производства мармелада и пастилы
- Технология производства мороженого
- Технология производства продуктов питания из картофеля
- Технология производства рыбных кулинарных изделий
- Технология производства мясных полуфабрикатов и пельменей
- Технология производства сливочного масла
- Технология производства сыра
- Технология производства мягких сыров
- Технология производства плавленых сыров
- Технология производства домашнего сыра
- Технология производства замороженных продуктов
- Технология производства пищевых концентратов
- Технология безалкогольных и слабоалкогольных напитков
- Газированные безалкогольные напитки
- Физико-химические основы сатурации воды
- Углекислый газ и пищевая жидкая углекислота
- Сырье и полуфабрикаты для фруктовых напитков
- Извлечение сока из плодов
- Приготовление морсов и экстрактов
- Ароматные настои
- Производство газированных фруктовых напитков
- Сухие напитки
- Повышение стойкости газированных напитков
- Стеклянная тара и ее подготовка
- Минеральные воды
- Хлебный квас и другие продукты сбраживания
- Химические процессы при сушке ржаного солода
- Технология сухого ржаного солода
- Производство кваса и газированных хлебных напитков
- Технология плодово-ягодных напитков брожением
- Технология производства соков
- Технология производства вин и коньяков
- Технология производства пива
Физико-химические основы сатурации воды
Факторы, влияющие на процесс абсорбции: Давление.
Растворимость газов в жидкости зависит от природы газа и жидкости, парциального давления газа над жидкостью, температуры раствора, содержания в нем электролитов и коллоидов. Важнейшими из факторов, влияющих на процесс абсорбции, являются давление и температура.
Давление. При взаимодействии газа с водой возникает система, состоящая из двух фаз (газообразной и жидкой) и двух компонентов (углекислого газа и воды). По правилу фаз условия равновесия дайной системы выражаются уравнением:

где f - число степеней свободы; n - число компонентов системы; К - число фаз. Система углекислый газ - вода, для которой n=2 и К=2, имеет две степени свободы, т. е. в данной системе два параметра могут произвольно изменяться, при этом число фаз и природа фаз не изменяются. Фазовое равновесие системы определяется давлением, температурой и концентрацией. При постоянной температуре концентрация будет находиться в однозначной зависимости от давления. Эта зависимость для идеальных газов выражается законом Генри, согласно которому концентрация растворенного газа пропорциональна его парциальному давлению над раствором;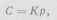
где С - молярная концентрация газа в растворе; р - парциальное давление газа над раствором; К - константа фазового равновесия, зависящая от природы газа и температуры. Закон Генри для углекислого газа справедлив до давления 0,39 - 0,49 Мн/м2 (4 - 5 кг/см2) несмотря на химическое взаимодействие газа с водой. При более высоком давлении растворимость углекислого газа несколько ниже растворимости, соответствующей закону Генри.
Зависимость между К и р для этих условий находят по эмпирической формуле, поелложенной Я. Д. Зельвинским:

где а и В - постоянные величины, значения которых зависят от температуры: при 0°С а=1,84 и В=0,025.
Таблица 2. Коэффициент абсорбции а углекислого газа в воде при температуре 0°С и различном давлении
Давление |
| Давление |
| ||
в кг/см2 | в кн/м2 | а в м3/м3
| в кг/см2 | в кн/м2 | а в м3/м3
|
1 | 101,3 | 1,71 | 7 | 709,1 | 10,28 |
2 | 202,6 | 1,8 | 8 | 810,4 | 11,78 |
3 | 303,9 | 3,56 | 9 | 911,7 | 13,20 |
4 | 405,2 | 5,32 | 10 | 1013 | 14,65 |
5 | 506,5 | 7,02 | 11 | 1114,3 | 16,03 |
6 | 607,8 | 8,65 | 12 | 1215,6 | 17,25 |
Влияние давления на растворимость углекислого газа в воде видно из табл. 2.
Из табл. 2 видно, что растворимость углекислого газа значительно увеличивается с повышением давления. При повышении давления от 1 до 4 кг/см2 (от 101,3 до 405,2 кн/м2) растворимость возрастает более чем в 3 раза.
Согласно закону Дальтона при растворении смеси газов каждая составная часть смеси растворяется пропорционально своему парциальному давлению и коэффициенту растворимости. Общее давление газовой смеси равно сумме парциальных давлений компонентов, входящих в состав смеси. Таким образом, при наличии в углекислом газе других газов, например, воздуха, парциальное давление углекислого газа будет составлять часть общего давления газовой смеси и соответственно концентрация его в растворе будет ниже, чем при отсутствии воздуха.
Наличие воздуха в углекислом газе и в водном растворе не только уменьшает растворимость газа, но также уменьшает прочность абсорбционной связи растворенного газа с водой. Поэтому при проведении сатурации создают условия, при которых в газообразной и в жидкой фазах воздуха не содержится.
- Главная
- Технология безалкогольных и слабоалкогольных напитков
- Физико-химические основы сатурации воды
- Факторы, влияющие на процесс абсорбции: Давление.


